И. Г. Хомченко, А. В. Трифонов, Б. Н. Разуваев. «Современный аквариум и химия». г. Москва. «Новая волна».
НУЖНА ЛИ МЯГКАЯ ВОДА?
Всем хорошо известно, что
если в воду поместить кусочек мыла и размешать, то образуется пена. В воде из различных
источников этот процесс происходит по-разному. Иногда образование пены
происходит очень быстро, она обильна и удерживается долго. Такая вода
называется мягкой. Бывает, что пена образуется с большим трудом и только
при внесении большого количества мыла. Это происходит в так называемой жесткой
воде. Термины «мягкая» и «жесткая» вода отражают свойство воды, играющее
важную роль в аквариумном рыбоводстве. Это жесткость воды.
Жесткость воды обусловлена растворенными в
ней солями кальция и магния: чем больше в воде растворенных соединений, тем она
жестче. Самая мягкая вода вообще не содержит растворенных солей кальция и
магния. В природных водоемах такая вода не встречается, Получить воду,
практически не содержащую солей, можно различными способами, например, путем
перегонки, или дистилляции. Этот метод основан на следующем: вода при кипячении
испаряется, пары улавливаются, конденсируются (т. е. вновь превращаются в
жидкость) и, таким образом, образуется вода с пониженным содержанием
растворенных веществ. Более подробно о способах удаления растворенных солей из
воды будет рассказано в главе, которая посвящена подготовке воды для аквариума.
Какие же вещества
обусловливают жесткость воды? Это карбонаты — соли кальция и магния: CaCO3
и CaCO3 гидрокарбонаты Ca(HCO3)2 и
Mg(HCO3)2, сульфаты CaSO4 и MgSO4, хлориды CaCl2 и
MgCl2. Набор веществ, содержащихся в воде, может быть самым
различным, что обусловлено геологическими особенностями той местности, где
расположен водоем.
Карбонаты кальция и магния
относятся к веществам, которые очень мало растворяются в воде: при температуре
20°C в 1 л может раствориться 7 мг CaCO3 и 270 мг CaCO3.
Однако этого достаточно, чтобы сделать воду жесткой.
Растворимость карбонатов
кальция и магния существенно возрастает в присутствии углекислого газа, а этот
газ, как известно, содержится в воздухе, который обычно пропускают через
аквариум; его выделяют при дыхании рыбы и другие животные. В присутствии CO2
протекают
реакции:
CaCO3 + СO2
+ H2O = Ca(HCO3)2
MgСO3 + СO2 + H2O = Mg(HCO3)2
В результате образуются
хорошо растворимые в воде гидрокарбонаты кальция и магния. Как правило, именно
эти соли, а не карбонаты, содержатся в жесткой воде.
Для жесткой воды обычно
различают временную, или карбонатную, и постоянную, или
некарбонатную, жесткость. Первая обусловлена присутствием в воде Ca(HCO3)2
и Mg(HCO3)2. Временной жесткость называется потому,
что при кипячении гидрокарбонаты разлагаются, и образующиеся карбонаты кальция
и магния в значительном количестве выпадают в осадок:
Ca(HCO3)2 ―t→ CaCO3↓ + CO2
+ H2O
Mg{HCO3)2 ―t→ CaCO3↓
+ CO2 + H2O
Выпадающий осадок образует так
называемую накипь на стенках посуды, в которой кипятится вода. За счет
кипячения и удаления гидрокарбонатов из воды она умягчается.
Постоянная жесткость обусловлена присутствием в
воде сульфатов, хлоридов и некоторых других солей кальция и магния, которые не
удаляются при кипячении. Сумма временной и постоянной жесткости дает общую
жесткость воды.
Для количественной
характеристики жесткости можно использовать значение концентрации ионов Са2+
и Mg2+ в воде в мг/л, однако в литературе по аквариумистике
наибольшее распространение получили другие единицы жесткости.
В России и странах СНГ для
выражения жесткости воды используются миллиграмм-эквиваленты (миллиэквиваленты)
ионов кальция и магния, содержащиеся в 1л воды*. Одному миллиграмм-эквиваленту
в литре (мг-экв/л) соответствует содержание в воде 20,04 мг/л Ca2+ или 12,16 мг/л Mg2+,
т. е. жесткость в мг-экв/л (Ж) может быть рассчитана по формуле:
Ж =
|
x(Ca2+) |
+ |
x(Mg2+) |
|
(9) |
20,04
|
12,16
|
|
где x(Ca2+) и x(Mg2+) —
концентрация в мг/л ионов кальция и магния соответственно.
* В связи с
принятием международной системы единиц СИ понятия «грамм-эквивалент» и «миллиграмм-эквивалент»
были отменены. Однако, поскольку они все еще часто встречаются в литературе по
аквариумистике и гидрохимии, мы сочли возможным использовать их в данной книге.
В аквариумной практике
обычно выражают жесткость в так называемых немецких градусах. Один градус
жесткости по этой шкале соответствует содержанию в 100 000 г воды 1 г оксида
кальция CaO или 0,719 г оксида магния MgO. Для выражения жесткости в немецких
градусах надо пересчитывать концентрацию ионов Са2+ и Mg2+
на концентрацию CaO и MgO по отношению молярных масс. Проведя такой расчет,
легко получить, что 1 градус жесткости соответствует содержанию в воде 7,15
мг/л ионов Са2+ или 4,34 мг/л ионов Mg2+. Жесткость,
выраженную в градусах, в дальнейшем мы будем обозначать символом dGH (в
литературе встречаются различные обозначения: dH, GH, dGH и др.). В соответствии с
вышеизложенным для расчета жесткости в градусах можно использовать формулу:
dGH =
|
x(Ca2+) |
+ |
x(Mg2+) |
|
(10) |
7,15
|
4,34
|
|
Как уже отмечалось раньше, общая
жесткость dGH складывается из временной жесткости (обозначение dKH) и
постоянной жесткости (dNKH),поэтому можно записать:
|
dGH = dKH + dNKH. |
(11) |
Если известна жесткость в мг-экв/л
(Ж), то, используя переходной коэффициент, можно перейти к жесткости в градусах
(dGH) и наоборот. Формулы для перерасчета выглядят так:
|
dGH = 2,804 • Ж |
(12) |
|
Ж = 0,35663 • dGH. |
(13) |
Кроме единиц жесткости, о которых
мы рассказали, существуют также французские, английские и американские градусы
жесткости, которые встречаются в литературе, особенно в той, которая издается в
этих странах. Французский градус соответствует содержанию 10 мг карбоната
кальция CaCO3 в 1 л воды; английский — 1 грана (0,06482 г) CaCO3
в 1 галлоне (4,546 л) воды; американский градус — 1 мг CaCO3 в 1 л
воды. Перейти от этих способов выражения жесткости воды к Ж (мг-экв/л) или к
dGH можно, используя переходные коэффициенты, приведенные в табл. 7. Надо
заметить, что существование различных единиц жесткости часто приводит к ошибкам
в литературе и в любительских рекомендациях. Поэтому аквариумистам надо
внимательно следить за тем, в каких единицах выражена жесткость воды.
Таблица 7 Соотношения между различными способами выражения
жесткости воды
|
Единицы,
в которых выражена жесткость |
Коэффициенты
(множители) для перевода жесткости |
|
|
в мг-экв/л (Ж) |
в немецкие градусы (dGH) |
|
|
Французские градусы Английские градусы Американские градусы |
0,19982 0,28483 0,01998 |
0,5603 0,7987 0,0560 |
Приведем пример расчета
жесткости воды по приведенным выше формулам.
Пример. В 2 л воды растворено 50,1
мг ионов кальция и 60,8 мг ионов магния. Определите жесткость воды в мг-экв/л и
в немецких градусах.
Решение. Вначале рассчитаем массовую
концентрацию в мг/л (формула 3) ионов кальция и магния:
|
x(Ca2+)
= |
m(Ca2+) |
; |
x(Ca2+)
= |
50,1 мг |
= 25,05 мг/л. |
V
|
2 л |
||||
|
|
|
|
|
|
|
|
x(Mg2+)
= |
m(Mg2+) |
; |
x(Mg2+)
= |
60,8 мг |
=
30,4 мг/л. |
V
|
2 л |
Используя формулу (9),
рассчитываем жесткость воды в мг-экв/л;
|
Ж = |
x(Ca2+) |
+ |
x(Mg2+) |
; |
|
|
20,04 |
12,16 |
||||
|
|
|
|
|
|
|
|
Ж = |
25,05 |
+ |
30,04 |
= 1,25 + 2,5 = 3,75 мг-экв/л. |
|
|
20,04 |
12,16 |
||||
По формуле (10) можно
рассчитать жесткость, выраженную в немецких градусах:
|
|
dGH =
|
x(Ca2+) |
+ |
x(Mg2+) |
; |
|
7,15 |
4,34 |
||||
|
|
|
|
|
|
|
|
|
dGH =
|
25,05 |
+ |
30,04 |
= 3,5 + 7 = 10,5. |
|
7,15 |
4,34 |
||||
Для расчета жесткости dGH
можно было величину Ж умножить на переходный коэффициент (формула 12):
dGH = 2,804 • Ж ; dGH = 2,804 • 3,75 = 10,5.
Аквариумную воду в
зависимости от ее жесткости принято классифицировать следующим образом: очень
мягкая — жесткость до 5°dGH, мягкая — 5—10°, средней жесткости (умеренно
жесткая) — 10—20°, жесткая — 20—30° и очень жесткая — свыше 30°.
Какая жесткость воды в
аквариуме устраивает ее обитателей? Для ответа на этот вопрос вновь обратимся к
гидрохимическому режиму природных водоемов — в большинстве случаев желательно
создать рыбам такие условия, в которых они или их предки жили в природе. В
табл. 8 приведены сведения о жесткости воды в некоторых природных водоемах, в
которых живут аквариумные рыбы.
Как видно из таблицы,
жесткость в природной среде обитания аквариумных рыб изменяется в широких
пределах: значение dGH меняется от 0,2° до 20° и даже больше. Большинство рыб
не могут нормально существовать и развиваться в совершенно мягкой воде, т. к.
им необходим кальций. При недостатке этого элемента в воде замедляется рост
рыб, возникают уродства скелета у мальков. Растения плохо развиваются при
недостатке как кальция, так и магния.
Размножение некоторых рыб
(неоны, пециллобриконы и др.) рекомендуется проводить в очень мягкой воде. В
природных водоемах эти рыбы нерестятся в период дождей, когда речная вода
значительно разбавляется водой, которая практически не содержит растворенных
солей и имеет слегка кислую реакцию. Однако все сказанное относится, главным
образом, к карбонатной жесткости (dKH). Некарбонатная жесткость
(dNKH) может оставаться достаточно высокой (несколько градусов) даже при
разведении неонов и других рыб.
Для успешного содержания в
аквариуме многих видов рыб необходима жесткая вода (популярные рыбы — живородящие,
цихлиды из африканских озер Малавии Танганьика).
Таким образом, можно
заключить, что в большинстве случаев рыбам подходит вода, содержащая
определенное количество солей кальция и магния (dGH от 5 до 20°), а очень
мягкая вода может использоваться, лишь как стимул к нересту для некоторых видов
рыб.
Таблица
8 Жесткость воды в некоторых природных
водоемах
|
Название
водоема |
Место
расположения водоема |
Жесткость
воды, мг-экв/л |
Жесткость
воды, dGH |
|
р. Амазонка (Сбидос) |
Южная Америка: Бразилия |
0,3 |
0,9 |
|
р. Парана |
Южная Америка: Аргентина |
0,6 |
1,6 |
|
р. Рио-Негру |
Южная Америка: Бразилия |
1,4 |
3,9 |
|
р. Рио-Гранде |
Центральная Америка: Никарагуа |
7,4 |
20,7 |
|
р. Нил (Каир) |
Африка: Египет |
1,5 |
4,2 |
|
р. Ньонг |
Африка: Камерун
|
0,18—0,36 |
0,5—1,0 |
|
оз. Танганьика |
Африка: Заир, Танзания |
4,3—7,2 |
12—20 |
|
р. Борай Пет |
Азия: Таиланд |
0,07—0,36 |
0,2—1,0 |
Подходит ли вода из наших природных
водоемов для содержания тропических аквариумных рыб и растений? В табл. 9
приведена жесткость воды в некоторых водоемах СНГ, измеренная в летний
период.
Во всех водоемах, где
проводились исследования, преобладает карбонатная жесткость, поэтому при
использовании воды из некоторых водоемов возникает необходимость увеличения
постоянной жесткости за счет растворения солей кальция и магния (CaSO4, СаС12, MgSO4, MgCl2. В Неве вода очень мягкая, для
содержания большинства рыб необходимо поднять как временную, так и постоянную
жесткость.
Таблица
9 Жесткость воды в некоторых водоемах
СНГ
|
Река |
Место
отбора пробы воды |
Общая
жесткость, dGH |
Карбонатная
жесткость, dKH |
Постоянная жесткость, dNKH |
|
Волга |
г. Старица |
8,4 |
7,0 |
1,4 |
|
Волга |
г. Кинешма |
9,0 |
5,7 |
3,3 |
|
Москва |
г. Коломна |
9,8 |
7,4 |
2,4 |
|
Нева |
с. Ивановское |
1,4 |
1,4 |
0 |
|
Западная Двина |
г. Полоцк |
6,6 |
4,9 |
1,7 |
|
Днестр |
г. Бендеры |
15,2 |
8,6 |
6,6 |
|
Дон |
г. Калач |
14,0 |
10,4 |
3,6 |
|
Енисей |
г. Красноярск |
3,6 |
3,3 |
0,3 |
|
Северная Двина |
с. Усть-Пинега |
8,8 |
5,1 |
3,7 |
|
Ока |
г. Калуга |
14,6 |
11,5 |
3,1 |
Жесткость воды в водоемах
нашей страны имеет значительные сезонные колебания. На рис. 8 показаны сезонные
колебания значения dGH для двух рек СНГ. Обычно максимальное значение жесткости
воды можно наблюдать в период зимней межени (январь — март). Во время весеннего
паводка наблюдается резкое падение dGH. Летом и осенью жесткость воды
постоянно возрастает и достигает максимума к зиме. Сезонные колебания жесткости
воды следует учитывать при периодической подмене воды в аквариуме. Особенно осторожным
аквариумисту надо быть в период весеннего паводка. В это время следует
отказаться от замены большого количества воды. Кроме резкого изменения
жесткости, существует опасность внесения в аквариум нежелательных веществ,
которые попадают в водоемы с талыми водами.
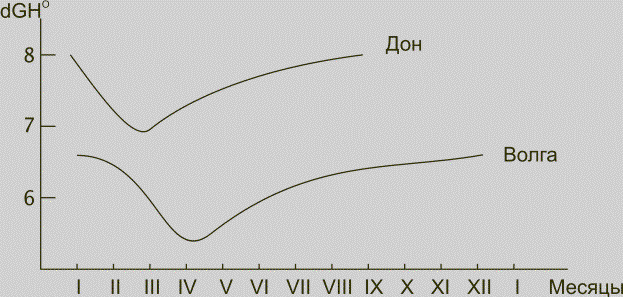
Рис. 8. Сезонное изменение жесткости в водоемах
России: 1 — р. Волга (г. Ржев), 2 — р.
Дон (cm-ца Раздольская)
В процессе эксплуатации аквариума жесткость воды в нем несколько изменяется
в ту или другую сторону. Например, если грунт содержит карбонатные породы
(известняк, мел, мрамор, доломит и др.), может происходить их медленное
растворение. При отсутствии в воде углекислого газа это растворение протекает
малозаметно. Однако если в аквариум при помощи компрессора попадает воздух из
жилого помещения с достаточно высоким содержанием CO2, то процесс ускоряется за
счет протекания реакции:
CaCO3 + CO2 + H2O = Ca(HCO3)2
Жесткость воды увеличивается
и за счет испарения воды. При этом растворенные соли остаются в аквариуме и их
концентрация увеличивается (в некоторых руководствах рекомендуют доливать в
аквариум дистиллированную воду взамен испарившейся, чтобы не возрастала
жесткость, однако, это не всегда осуществимо).
Жесткость воды несколько
уменьшается вследствие выпадения в осадок карбонатов кальция и магния при
подкисления воды, а также в результате поглощения ионов кальция и магния рыбами
и некоторыми аквариумными растениями (особенно потамогетонами и эхинодорусами).
Изменение жесткости воды в
аквариуме происходит достаточно медленно, если регулярно проводить подмену воды
(25—30% еженедельно), то резких колебаний жесткости можно избежать.
Если нужно увеличить
карбонатную жесткость воды, в аквариум следует поместить известняк и создать в
воде достаточную концентрацию CO2 (например, установить
продувку воды воздухом). Для увеличения не карбонатной жесткости обычно
добавляют раствор хлорида кальция CaCl2 и сульфата магния MgSO4. Уменьшить жесткость воды
несколько сложнее. Здесь наиболее простой путь — добавление дистиллированной,
смягченной (иногда — дождевой) воды.
Жесткость воды связана с ее
кислотностью. Чем более жесткой является вода, тем она более щелочная. На рис.
9 показана зависимость значения водородного показателя воды от ее жесткости.
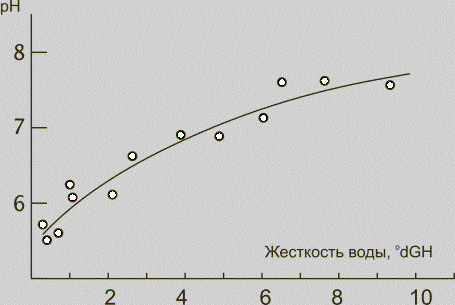
Рис. 9. Связь между жесткостью воды и ее
кислотностью
Связь между жесткостью воды
и pH можно легко объяснить. Как мы уже видели раньше, в жесткой воде
преобладает временная или карбонатная жесткость, т. е. в ней содержатся соли
Ca(HCO3)2 и Mg(HCO3)2. Эти соли в
водном растворе подвергаются гидролизу — взаимодействуют с водой. Схему
гидролиза Ca(HCO3)2 можно записать следующим образом:
диссоциация Ca(HCO3)2 = Са2+
+ 2HCO3‾
гидролиз HCO3‾ + H2O = H2СO3 + ОН‾
Из уравнения гидролиза видно,
что в результате устанавливающегося равновесия в воде накапливаются
гидроксид-ионы ОН‾, которые обусловливают щелочную реакцию среды.
Все вышесказанное не
означает однако, что нельзя получить жесткую воду с кислой реакцией. Такая вода
должна содержать хлориды и сульфаты кальция и магния, т. е. в ней преобладает
постоянная (некарбонатная) жесткость. Такую среду можно получить, если добавить
в мягкую воду соответствующие соли или подкислить обычную воду с карбонатной
жесткостью соляной или серной кислотой. При подкислении будет происходить
разложение гидрокарбонатов, например:
Mg(HCO3)2
+ 2HCl = MgCl2 + CO2 + H2O
Мягкая вода обычно имеет
значение pH меньше 7. Кислые свойства мягкой воды связаны, главным образом, с
растворением CO2 и образованием угольной кислоты, о чем мы уже
говорили в предыдущем разделе.
В зависимости от жесткости и
связанной с ней кислотности можно различить три основные разновидности
аквариумной воды, пригодной для содержания определенных представителей пресноводной
гидрофауны и гидрофлоры;
1) кислая и мягкая вода;
2) вода с нейтральной
реакцией и средней жесткостью;
3) щелочная и жесткая вода;
Если аквариумист создаст все
три вида аквариумов, то практически он может содержать всех представителей
пресноводных тропических рыб и растений. Если этого сделать не удастся, то
выбор рыб и растений будет ограничен.
Таблица
10 Представители пресноводной
гидрофауны и гидрофлоры, подходящие для различных видов аквариумной воды
|
Гидробионты |
Кислая и мягкая вода |
Нейтральная вода средней жесткости |
Щелочная и жесткая вода |
|
Тропические рыбы |
Неон (Paracheirodon innesi), лялиус (Colisa lalia) |
Данио-рерио (Brachydanio rerio), цихлазома Меека (Cichlasoma meeki) |
Псевдотрофеус зебра (Pseudotropheus zebra), велифера (Poecilia velifera) |
|
Водные растения |
Болбитис (Bolbitis heudelotii), ротала Валлиха (Rotala wallichii) |
Криптокорина Вендта (Cryptocoryne wendtii), лимнофила водная (Limnophila aquatica) |
Эхинодорус (Echinadorus horisontalis), анубиас нана (Anubias barteri,
var. nаnа) |
Например, нельзя совместить
в одном аквариуме, два вида рыб из семейства цихлид: дискуса (Symphysodon diskus) из южноамериканской реки Риу-Негру, которому нужна
мягкая и кислая вода, и юлидохромиса орнатуса (Julidochromis ornatus)
из африканского озера Танганьика. Этой рыбе подходит щелочная жесткая вода. В
табл. 10 показано, какие водные организмы могут содержаться в аквариуме каждого
вида.
Следует отметить, что
некоторые гидробионты легко адаптируются к условиям содержания, могут
развиваться в воде различного гидрохимического состава. Например, людвигия (Ludvigia repens) хорошо растет и развивается как в кислой мягкой,
так и в жесткой щелочной воде. К воде различной кислотности и жесткости легко
адаптируются сомики из рода коридорас, например, крапчатый сомик (Corydoras paleatus),