И. Г. Хомченко, А. В. Трифонов, Б. Н. Разуваев. "Современный аквариум и химия". г. Москва, "Новая волна".
Определение общей жесткости
воды
Аквариумисту очень полезно научиться определять общую жесткость воды.
Это достаточно просто. Метод определения общей жесткости основан на
взаимодействии ионов кальция и магния, содержащихся н воде, с динатриевой солью
этилен-диаминтетрауксусной кислоты (техническое название — «Трилон Б»), Эта
соль образует с ионами Ca2+ и Mg2+ прочные комплексные
соединения. В процессе анализа к пробе воды постепенно прибавляют раствор
трилона Б до полного взаимодействия с ионами кальция и магния. Окончание
реакции определяют по изменению окраски специального вещества — индикатора,
который добавляют в воду. Такой метод в аналитической химии получил название
«титрование».
Для проведения анализа необходимы следующая химическая посуда и
оборудование:
1. Бюретка или микробюретка (рис. 17, а, б). В некоторых руководствах
указывается, что нужна обязательно микробюретка, но это не так. Достаточно точный анализ можно
провести, применяя обычные бюретки (на 10, 25 или 50 мл), которые проще
достать, а при необходимости можно изготовить из стеклянной трубки,
отградуировав ее.
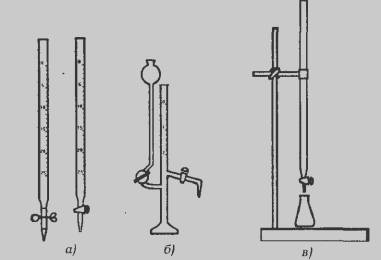
Рис. 17. Бюретки (а) и микробюретка (б) для
титрования; в) закрепление бюретки в штативе для титрования
Для проведения титрования бюретку закрепляют в металлическом штативе
при помощи зажимов, как показано на рис. 17, в, Можно изготовить самодельное
приспособление для закрепления бюретки. Однако надо учитывать, что оно не
должно закрывать измерительную шкалу и затруднять заливание растворов в
бюретку.
2. Пипетка для отбора пробы воды на 25 или 50 мл (рис. 18, а). Вода в
такую пипетку набирается при помощи резиновой груши. При необходимости
требуемый объем воды можно отбирать мерными цилиндрами или мензурками (рис. 18,
б, в), что, однако, менее точно.
3 Конические колбы вместимостью 200—250 мл, в которых проводится
титрование (рис. 18,г).
4. Мерные колбы на 100, 200, 250, 500 или 1000 мл (рис. 18,д), которые
используются для точного приготовления растворов с требуемой молярной концентрацией. Делается это
так: в колбу определенной вместимости вносится рассчитанное количество
растворяемого вещества. Наливают воду приблизительно на 3/4 объема колбы.
Закрыв колбу пробкой, интенсивно встряхивают до полного растворения вещества.
После этого доливают воду до метки на горле колбы и несколько раз
переворачивают до полного перемешивания. При отсутствии мерных колб можно
использовать обычные бутылки, нанеся на них отметки.
5. Весы, позволяющие брать навески веществ для приготовления растворов
с точностью до 0,01 г.
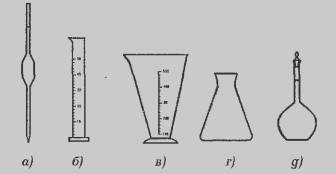
Рис. 18. Пипетка (а), мерный цилиндр (б),
мензурка (в), коническая колба (г), мерная колба (д).
Теперь о том, какие реактивы и растворы потребуются для определения
жесткости воды. Для приготовления всех растворов, используемых при химическом
анализе, надо использовать дистиллированную или химически обессоленную воду.
1. Раствор трилона Б. Для титрования готовят 0.025M
раствор трилона Б, взяв 9,3 г этой соли на 1 л раствора (или 4,65 г на
пол-литровую колбу).
Если вода достаточно мягкая, то для повышения точности определения
можно использовать 0,01М раствор трилона Б. Для приготовления такого раствора
на литровую колбу нужно взять 3,72 г соли.
2. Буферный раствор, содержащий хлорид аммония и водный раствор
аммиака. Этот раствор позволяет поддерживать рН около 10, что необходимо для
точного определения жесткости.
Для приготовления буферного раствора в колбу на 500 мл вносят 10 г
хлорида аммония NH4Cl и 50 мл концентрированного
(20—25%-ного) раствора аммиака. Доливают дистиллированную воду до отметки 500
мл.
3. Индикатор. В качестве индикатора можно использовать: эриохром черный
Т, хромоген ЕТ-00, кислотный хром темно-синий или кислотный хром синий К.
Растворы этих индикаторов не могут храниться длительное время.
Лучше всего индикатор размешать с сухим хлоридом калия KCl или
хлоридом натрия NaCl (поваренная соль) в отношении 1:2. При титровании
полученную смесь понемногу добавлять в воду.
Проведение анализа. При помощи пипетки или цилиндра (мензурки) отмеряют
50 мл воды и вносят в коническую колбу на 200—250 мл. Добавив 50 мл аммиачного
буферного раствора, вносят щепотку (на кончике стеклянного или бумажного
шпателя) индикаторной смеси (индикатор + соль).
В бюретку наливают раствор трилона Б, доведя его объем точно до верхнего
нулевого деления бюретки. Затем проводится титрование: в колбу при непрерывном
перемешивании добавляют раствор трилона Б из бюретки мелкими порциями. В конце
титрования, когда начинает изменяться окраска индикатора, раствор трилона Б из
бюретки добавляют по каплям.
Титрование прекращают после изменения цвета индикатора с красного (или
лилового) на синий. После этого по бюретке замеряют объем раствора трилона Б,
пошедшего на титрование VT.
Титрование надо проводить трижды, а если есть большие расхождения в
значениях VT, то и большее число раз. Для расчетов
применяют среднее арифметическое значение объема раствора трилона Б,
использованного на титрование.
Зная объем VT (в мл), объем воды, взятой на титрование VT, (в данном случае — 50 мл), и молярную концентрацию раствора трилона Б
CT (0,025М или 0,01М), можно рассчитать жесткость воды
Ж (в мг-экв/л) или dGH (в градусах) по формулам:
|
Ж = |
2000 • VT • CT |
(17) |
|
VB |
Таблица 21. Определение жесткости воды
(dGH) по расходу 0,025М раствора трилона Б (на 50 мл воды)
|
dGH |
0,0 |
0,1 |
0,2 |
0,3 |
0,4 |
0,5 |
0,6 |
0,7 |
0,8 |
0,9 |
|
0 |
- |
0,04 |
0,07 |
0,10 |
0,14 |
0,18 |
0,21 |
0,25 |
0,28 |
0,32 |
|
1 |
0,36 |
0,39 |
0,43 |
0,46 |
0,50 |
0,53 |
0,57 |
0,60 |
0,64 |
0,68 |
|
2 |
0,71 |
0,75 |
0,78 |
0,82 |
0,85 |
0,89 |
0,93 |
0,96 |
1,00 |
1,03 |
|
3 |
1,07 |
1,10 |
1,14 |
1,18 |
1,21 |
1,25 |
1,28 |
1,32 |
1,35 |
1,39 |
|
4 |
1,43 |
1,46 |
1,50 |
1,53 |
1,57 |
1,60 |
1,64 |
1,68 |
1,71 |
1,75 |
|
5 |
1,78 |
1,82 |
1,85 |
1,89 |
1,92 |
1,96 |
2,00 |
2,03 |
2,07 |
2,10 |
|
6 |
2,14 |
2,17 |
2,21 |
2,25 |
2,28 |
2,32 |
2,35 |
2,39 |
2,42 |
2,46 |
|
7 |
2,50 |
2,53 |
2,57 |
2,60 |
2,64 |
2,67 |
2,71 |
2,75 |
2,78 |
2,82 |
|
8 |
2,85 |
2,89 |
2,92 |
2,96 |
2,99 |
3,03 |
3,07 |
3,10 |
3,14 |
3,17 |
|
9 |
3,20 |
3,24 |
3,28 |
3,32 |
3,35 |
3,39 |
3,42 |
3,46 |
3,50 |
3,53 |
|
10 |
3,57 |
3,60 |
3,64 |
3,67 |
3,71 |
3,74 |
3,78 |
3,81 |
3,85 |
3,89 |
|
11 |
3,92 |
3,96 |
3,99 |
4,03 |
4,06 |
4,10 |
4,14 |
4,17 |
4,21 |
4,24 |
|
12 |
4,28 |
4,31 |
4,35 |
4,39 |
4,42 |
4,46 |
4,49 |
4,53 |
4,56 |
4,60 |
|
13 |
4,63 |
4,67 |
4,70 |
4,74 |
4,79 |
4,81 |
4,85 |
4,88 |
4,92 |
4,96 |
|
14 |
4,99 |
5,03 |
5,06 |
5,10 |
5,13 |
5,17 |
5,21 |
5,24 |
5,28 |
5,31 |
|
15 |
5,35 |
5,38 |
5,42 |
5,45 |
5,49 |
5,53 |
5,56 |
5,60 |
5,63 |
5,67 |
|
16 |
5,71 |
5,74 |
5,78 |
5,81 |
5,85 |
5,88 |
5,92 |
5,96 |
5,99 |
6,03 |
|
17 |
6,06 |
6,10 |
6,13 |
6,17 |
6,21 |
6,24 |
6,28 |
6,31 |
6,35 |
6,38 |
|
18 |
6,42 |
6,46 |
6,49 |
6,53 |
6,56 |
6,60 |
6,63 |
6,67 |
6,70 |
6,74 |
|
19 |
6,78 |
6,81 |
6,85 |
6,88 |
6,92 |
6,95 |
6,99 |
7,03 |
7,06 |
7,10 |
|
20 |
7,13 |
7,17 |
7,20 |
7,24 |
7,28 |
7,31 |
7,35 |
7,38 |
7,42 |
7,45 |
или
|
dGH = |
5608 • VT • CT |
(18) |
|
VB |
Для оперативного определения жесткости по объему раствора трилона Б,
использованного на титрование, удобно пользоваться таблицами 21 и 22. С помощью
этих таблиц без специальных расчетов мы можем получить значение общей жесткости
с точностью до 0,1 °dGH.
Таблица 22 Определение жесткости воды (°dGH)
по расходу 0,01 М раствора трилона Б (на 50 мл воды)
|
dGH |
0,0 |
0,1 |
0,2 |
0,3 |
0,4 |
0,5 |
0,6 |
0,7 |
0,8 |
0,9 |
|
0 |
- |
0,09 |
0,18 |
0,27 |
0,36 |
0,45 |
0,53 |
0,62 |
0,71 |
0,80 |
|
1 |
0,89 |
0,98 |
1,07 |
1,16 |
1,25 |
1,34 |
1,43 |
1,52 |
1,60 |
1,69 |
|
2 |
0,78 |
1,87 |
1,96 |
2,05 |
2,14 |
2,23 |
2,32 |
2,41 |
2,50 |
2,59 |
|
3 |
0,67 |
2,76 |
2,85 |
2,94 |
3,03 |
3,12 |
3,21 |
3,30 |
3,39 |
3,48 |
|
4 |
0,57 |
3,66 |
3,74 |
3,83 |
3,92 |
4,01 |
4,10 |
4,19 |
4,28 |
4,37 |
|
5 |
0,46 |
4,55 |
4,64 |
4,73 |
4,81 |
4,90 |
4,99 |
5,08 |
5,17 |
5,26 |
|
6 |
5,35 |
5,44 |
5,53 |
5,62 |
5,71 |
5,80 |
5,88 |
5,97 |
6,06 |
6,15 |
|
7 |
6,24 |
6,33 |
6,42 |
6,51 |
6,60 |
6,69 |
6,78 |
6,87 |
6,95 |
7,04 |
|
8 |
7,13 |
7,22 |
7,31 |
7,40 |
7,49 |
7,58 |
7,67 |
7,76 |
7,85 |
7,94 |
|
9 |
8,02 |
8,11 |
8,20 |
8,29 |
8,38 |
8,47 |
8,56 |
8,65 |
8,74 |
8,83 |
|
10 |
8,92 |
9,00 |
9,09 |
9,18 |
9,27 |
9,36 |
9,45 |
9,54 |
9,63 |
9,72 |
В некоторых руководствах по аквариумистике (например, в книге В. С.
Жданова «Аквариумные растения») приводятся методики определения жесткости в
присутствии некоторых катионов (Cu2+, Zn2+, Mn2+). Наш опыт
проведения анализов воды, используемой в аквариумистике, показывает, что для
практических целей такой анализ не нужен, он лишь затрудняет определение и
требует дополнительных химических реактивов. Ошибка, вносимая этими ионами, для
воды, в которой могут жить рыбы и растения, обычно не превышает 0,1—0,2 °dGH.
Определение
карбонатной (временной) жесткости воды
Для определения карбонатной жесткости воды, которое проводится методом титрования
воды раствором соляной кислоты, необходима та же химическая посуда, что и для
определения общей жесткости (бюретка, пипетка или мерный цилиндр, коническая
колба, мерные колбы и весы).
Необходимые растворы.
1. Раствор соляной кислоты. Для титрования
обычно используют 0,05М раствор соляной кислоты (HCl).
Чтобы приготовить такой раствор, в литровую колбу внести 3 98 мл
(приблизительно 4 мл) концентрированной кислоты (38%-ной с плотностью 1,19
г/мл) и долить дистиллированную воду до метки на горловине колбы. Если
используется другой исходный раствор кислоты для приготовления 0,05М раствора,
то необходимо сделать пересчет. Раствором соляной кислоты заполняется бюретка,
2. Индикатор метиловый оранжевый. Это очень распространенный индикатор,
имеющийся во многих химических лабораториях. Для приготовления раствора этого
индикатора 0,1 г его растворяют в 100 мл дистиллированной воды.
Проведение анализа. В коническую колбу на 200-250 мл помещают отмеренное
количество (50 мл) анализируемой воды. Добавляют 3—4 капли раствора метилового
оранжевого. Далее проводят титрование раствором кислоты из бюретки до изменения
окраски индикатора с желтой на розовую. По бюретке определяют объем раствора
кислоты, использованного на титрование VK. (в мл).
Расчет карбонатной жесткости проводится по формуле:
|
dKH = |
2804 • VK • CK |
(19) |
|
VB |
где CK — молярная концентрация раствора соляной кислоты
(0,05М) , VВ — объем воды, взятой для титрования (50 мл). Для
расчета карбонатной жесткости в мг-экв/л надо значение dKH разделить на 2,804.